![]() ¿Os imagináis qué relación puede haber entre nuestra dentadura y las estrellas? Aparte de estrellarte contra algo y perder parte de tus dientes, también hay una extraña relación cuyo intermediario son los neutrinos, tal y como ha sido publicado recientemente en la revista Science. Además, los neutrinos están de moda esta semana pues el premio Nobel de Física ha ido a parar a Kajita y McDonald por haber demostrado que éstos tienen una masa, muy pequeña y difícilmente medible, pero masa al fin y al cabo. Y es que los neutrinos son unas partículas bastante interesantes puesto que ahora mismo, mientras inviertes tu tiempo en leer esta entrada, estás siendo golpeado constantemente por estas cosas. Aunque más que golpeado, deberíamos decir que los neutrinos nos están atravesando sin cesar y no interfieren en prácticamente nada de nuestras vidas. Vamos, pasan más de ti que un camarero ajetreado en la costa cuando le pides algo.
¿Os imagináis qué relación puede haber entre nuestra dentadura y las estrellas? Aparte de estrellarte contra algo y perder parte de tus dientes, también hay una extraña relación cuyo intermediario son los neutrinos, tal y como ha sido publicado recientemente en la revista Science. Además, los neutrinos están de moda esta semana pues el premio Nobel de Física ha ido a parar a Kajita y McDonald por haber demostrado que éstos tienen una masa, muy pequeña y difícilmente medible, pero masa al fin y al cabo. Y es que los neutrinos son unas partículas bastante interesantes puesto que ahora mismo, mientras inviertes tu tiempo en leer esta entrada, estás siendo golpeado constantemente por estas cosas. Aunque más que golpeado, deberíamos decir que los neutrinos nos están atravesando sin cesar y no interfieren en prácticamente nada de nuestras vidas. Vamos, pasan más de ti que un camarero ajetreado en la costa cuando le pides algo.
Sin embargo, los neutrinos sí que pueden interactuar a veces con los átomos de los objetos, sobre todo si van cargados de energía. Realmente, dada la ingente cantidad de neutrinos que atraviesan el espacio constantemente, hay una probabilidad (extremadamente pequeña, eso sí) de que choquen contra un protón o neutrón, y lo saquen de donde está. Y aquí es donde podemos encontrar la conexión entre las estrellas, los neutrinos y nuestra dentadura. Como es bien sabido ya, los elementos químicos se forman en el corazón de las estrellas gracias a los procesos internos que ocurren, entre los que destaca la fusión. Pues bien, el flúor, uno de los componentes principales de nuestras pastas de dientes, es un elemento químico que está situado en la tabla periódica entre el oxígeno y el neón. Sin embargo, es un elemento bastante difícil de encontrar en el espacio en contraposición a la gran abundancia del oxígeno y del neón, que ocupan el tercer y quinto puesto en abundancia. ¡El flúor no aparece ni entre los 20 primeros!

La posición de los elementos químicos en la tabla periódica no está hecha al azar sino que sigue una serie de reglas, entre ellas el que el elemento químico siguiente a otro contiene un neutrón más que el anterior, que se corresponde con el número atómico. Es decir, que mientras que el hidrógeno tiene un número atómico de 1, y por lo tanto contiene un neutrón, el helio tiene un número atómico de 2 y por lo tanto contiene un par de neutrones. Así respectivamente. Si nos fijamos en la tabla periódica veremos que el oxígeno tiene un número atómico de 8, el flúor tiene 9, y el neón tiene un número de 10 neutrones. Es decir, que así sin meternos en mucho detalle, si lográsemos quitarle un neutrón al neón, ¡podríamos obtener flúor! Y esto es justamente lo que parece que ocurre. Una buena parte de los neutrinos que se forman lo hacen dentro de las estrellas también, y cuándo éstas explotan como supernovas, liberan neutrinos con una gran cantidad de energía. Al parecer, cuando estos energéticos neutrinos chocan contra un neutrón del núcleo atómico de un neón, acaban produciendo el flúor. Y por lo que se ve, una buena parte del flúor existente hoy en día se ha podido generar gracias a esta curiosa e interesante forma.
Vale, vale, pero ¿qué tiene que ver esto con las dentaduras? Como ya he dicho antes, el flúor es un elemento que está presente de forma habitual en nuestras pastas de dientes. ¿Os habéis preguntado alguna vez por qué? ¡No temáis! En ULÛM estamos para contaros todo lo que necesitéis saber sobre pastas de dientes y neutrinos. El caso es que nuestros dientes tienen varias capas, y entre ellas una de las más importantes es la del esmalte ya que les otorga dureza necesaria para su mecanismo de acción, y a la vez protección. Este esmalte está hecho principalmente de un compuesto que les da su característica dureza: la hidroxiapatita. El punto débil de este recio mineral tiene que ver con las bacterias que a veces habitan nuestra boca, y que producen ácido láctico. El ácido provoca una disminución del pH produciendo que la hidroxiapatita se vaya agujereando y por tanto aparecen las indeseadas caries, causantes de grandes desasosiegos en cuanto a salud y bolsillo. Pero el flúor es capaz de reaccionar con el esqueleto químico restante y producir el elemento salvador: la fluorapatita, un mineral más duro incluso que la hidroxiapatita y que además, es resistente a la acidez bucal. Y todo gracias al flúor, elemento que existe en gran parte gracias a los neutrinos.
Así que, ¿cómo os habéis quedado? En un momento hemos sido capaces de conectar los procesos que ocurren a nivel interno en una estrella, la emisión de neutrinos cargados de energía y el mantenimiento de nuestra dentadura gracias a la cual podemos ingerir alimentos. No es que la ciencia en sí sea curiosa, es que la naturaleza nunca dejará de asombrarnos desde las perspectivas más extrañas y bonitas que podamos imaginar ahora.
Daniel Martínez Martínez (@dan_martimarti) es licenciado en Ciencias Biológicas por la Universidad de Valencia, donde también realizó el máster Biología molecular, celular y genética. Realizó su doctorado a caballo entre el FISABIO (Fundación para el fomento de la investigación Sanitaria y Biomédica) y el IFIC (Instituto de Física Corpuscular). Su labor investigadora está centrada en el estudio de la relación entre la composición funcional y de diversidad de la microbiota humana, y el estado de salud-enfermedad de los individuos. Durante los últimos años ha mantenido una actividad de divulgación científica escrita, además de participar en la organización de eventos como Expociencia. Actualmente trabaja en el Imperial College de Londres.


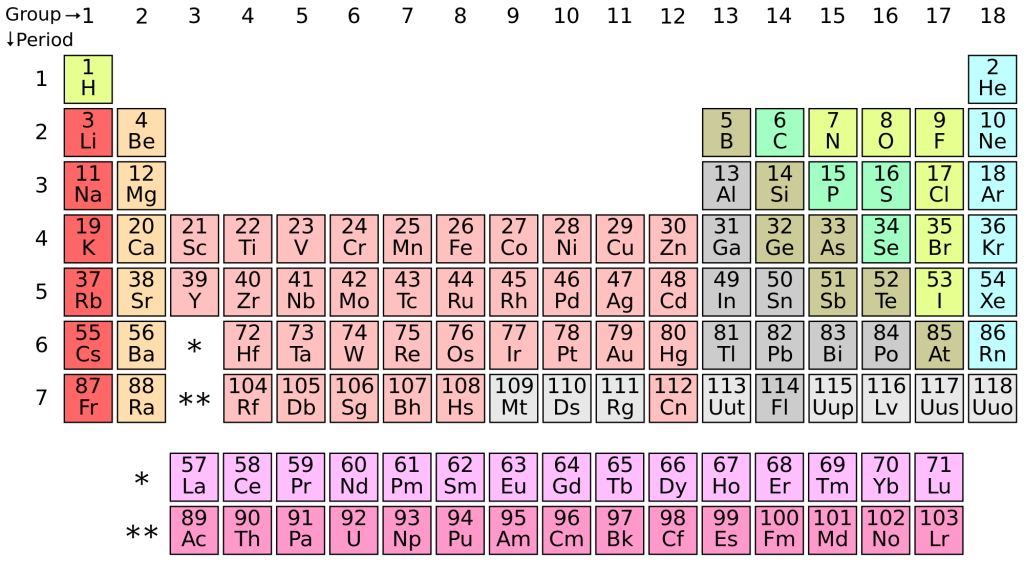
La tabla periódica está ordenada por el numero atómico que es el número de protones y no el de neutrones.
Así, el H es 1 porque tiene un protón (y 0 neutrones. El Deuterio sí tiene 1 n y el Tritio 2). El He es 2 porque tiene 2 protones, no por tener 2 neutrones. El siguiente es el Litio con 3 protones y 4 neutrones su isótopo más abundante,aunque también existe de 3 neutrones. El Carbono es 6 por tener 6 p, si bien su isótopo más abundante tiene también 6 n, y el oxígeno es 8 exactamente por lo mismo, tener 8 p aunque su isótopo más abundante sea de 8n. Pero habrás oído hablar del Carbono-14? Éste tiene 6 p y 8 n,que suman 14,su número másico,A (A = Z+N) (Z=N°atomico, protones. N=neutrones) Como ves el número de neutrones 8 no nos dice si se trata de C u O, como tampoco si nos dijesen que tiene 2 n pues podría ser Tritio o Helio. Sólo el número de protones define de que átomo se trata, pues electrones y neutrones pueden variar para el mismo elemento y coincidir con el de otro.
Es un error de 3ESO y ahora con LOMCE de 2ESO. Error grave. Para no seguir leyendo.
Me fui directamente al artículo de Science.Explica que cuando una estrella masiva explota desprende ciertos neutrinos energéticos capaces de arrancar un protón o un neutrón del núcleo de Neón. No dice que para formar Flúor a partir del Neón tiende que arrancarse un protón, pero es una información (de 2ESO)que se presupone conocida por el lector. Como profesor este hecho es una prueba más de que no debe dejarse ni un cabo suelto por fácil que resulte. Ese cabo suelto ha resultado fatal para el articulista.
Cómo es posible que nadie en esta plataforma se haya dado cuenta más habiendo transcurrido ya un año de la publicación? He buscado los editores. Dos biólogos y un ambientalista. OS urge diversificar.
Por mi parte tenéis todo mi apoyo a seguir trabajando y construyendo esta maravillosa página.
Dentro de un tiempo revisaré este artículo para comprobar si lo habéis rectificado. Sólo así podré recomendar esta página a mis alumnos.
Hola Ángel Martínez, tienes razón en tu comentario. En cuanto tenga un poco de tiempo libre lo editaré.
Agradezco tu intención de ayuda, pero sinceramente me ha parecido un comentario algo duro sin necesidad. Somos un grupo de aficionados a la divulgación científica que intentamos hacer el mejor trabajo que podemos, y como en todo, puede haber fallos. Por lo que veo debes ser de física o química, por lo que imagino que comprenderás la dificultad añadida de hablar sobre un tema que no es el tuyo. No creo que sea necesario un comentario con frases como: «Es un error de 3ESO y ahora con LOMCE de 2ESO. Error grave. Para no seguir leyendo.»
Sobre la diversificación, sí, es un tema pendiente que tenemos. Pero es algo complicado ya que no hay mucha gente que esté dispuesta a dedicar algo de su tiempo a la escritura o generación de contenido en una página minoritaria como esta. Así que mientras tanto tenemos que aprovechar al máximo colaboraciones tan valiosas de gente de «fuera» como Víctor Buendía, que aporta algo de variedad al asunto.
De todas formas, vuelvo a decirte que agradezco tu apreciación, y el artículo será corregido en el futuro cercano.
Un saludo.
Leo en la respuesta de Daniel Martinez a lo que escribe Ángel Martínez (sobre el fallo de nombrar neutrón por protón): «… tienes razón en tu comentario. En cuanto tenga un poco de tiempo libre lo editaré.»
Aún no se ha rectificado, y ya estamos a mitad de 2019 🙁